(2)离子化合物的电子式表示方法:
在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。所以,在离子化合物的电子式中由阳离子和带中括号的阴离子组成,简单的阳离子一般用离子符号表示,而阴离子和复杂的阳离子则不同,在元素符号周围一般用小黑点(或×)表示最外层电子数,外面再加[ ],并在[ ]右上方标出所带电荷,构成离子化合物的每个离子都要单独写,不可合并。
如: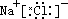
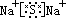
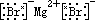
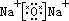
(3)离子化合物的形成过程:

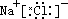

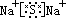
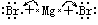
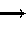
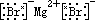
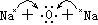
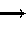
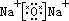
(二)共价键
1、定义:原子间通过共用电子对所形成的相互作用。
2、共价键三个物理量
(1)键能:是指1.01×105Pa和25℃下将1mol理想气体分子AB拆开为中性气态原子A和B时所需的能量。
单位:kJ·mol-1
特征:键能越大,共价键越牢固,含有该键的分子越稳定。
(2)键长:在分子中两个成键原子的核间平均距离叫键长,指原子间所形成的键。
特征:键长越短,键就越强、越牢固。
(3)键角:在分子中键与键之间的夹角叫键角。键角可反映分子的空间构型,可进一步帮助我们判断分子的极性。
3、极性共价键和非极性共价键
(1)非极性共价键:成键原子性质完全相同时,共用电子对在成键原子的正中间不偏向任何一方,或电子云在成键原子核之间中央区域最密集。如Cl—Cl等。
(2)极性共价键:成键原子的性质不完全相同,其电子对偏向成键的某原子。如H—Cl中电子对偏向Cl原子。
4、配位键(一种特殊的共价键)
定义:凡共用电子对仅由一个原子提供,而跟另一个原子或离子共用而形成的共价键。
形成条件:在成键原子中,一方必须有孤对电子,另一方必须有容纳孤对电子的空轨道。
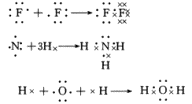
5、共价化合物的电子式表示方法:
在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。
如: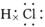
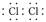
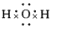
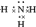
共价化合物的形成过程:
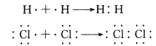
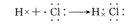
(三)化学键
1、定义:使离子相结合或原子相结合的作用力。
说明:
(1)原子通过化学键形成稳定结构。
如: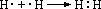
(2)原子间存在强烈作用
如拆开 1mol H2为H原子需436kJ能量。
(3)原子结合成分子后,体系能量降低。
2、化学键的类型

(四)极性键和非极性键
共价键根据成键的性质分为非极性共价键和极性共价键。
1、极性键:
不同种原子,对成键电子的吸引能力不同,共用电子对必然偏向吸引电子能力强(即电负性大)的原子一方,使该原子带部分负电荷(δ-),而另一原子带部分正电荷(δ+)。这样,两个原子在成键后电荷分布不均匀,形成有极性的共价键。
(1)不同种元素的原子形成的共价键叫极性共价键,简称极性键。
(2)形成条件:不同非金属元素原子间配对(也有部分金属和非金属之间形成极性键)。
(3)存在范围:气态氢化物、非金属氧化物、酸根、氢氧根、有机化合物。
2、非极性共价键:
(1)定义:(同种元素的原子)两种原子吸引电子能力相同,共用电子对不偏向任何一方,成键的原子不显电性,这样的共价键叫非极性键。简称非极性键。
(2)形成条件:相同的非金属元素原子间电子配对
(3)存在范围:非金属单质(稀有气体除外)及某些化合物中,如
H2、N2、O2、H2O2中的O-O键、Na2O2中的O-O键。
3、物质中化学键的存在规律:
(1)离子化合物中一定有离子键,可能还有共价键。简单离子组成的离子化合物中只有离子键,如MgO、NaCl等,复杂离子(原子团)组成的离子化合物中既有离子键又有共价键,既有极性共价键,又有非极性共价键。如:
只含有离子键:MgO、NaCl、MgCl2
含有极性共价键和离子键:NaOH、NH4Cl、Na2SO4
含有非极性共价键和离子键:Na2O2、CaC2等
(2)共价化合物中只有共价键,一定没有离子键。
(3)在非金属单质中只有共价键:
(4)构成稀有气体的单质分子,由于原子已达到稳定结构,在这些原子分子中不存在化学键。
(5)非金属元素的原子之间也可以形成离子键,如NH4Cl
4、化学键强弱的比较:
(1)离子键:离子键强弱的影响因素有离子半径的大小的离子所带电荷的多少,既离子半径越小,所带电荷越多,离子键就越强。离子键的强弱影响物质的熔沸点、溶解性,其中离子键越强,熔沸点越高。
(2)共价键:影响共价键强弱的因素有成键原子半径和成键原子共用电子对数,成键原子半径越小,共用电子对数目越多,共价键越稳定、越牢固。例如:r(H)<r(Cl),所以H2比Cl2稳定,N2中含有N≡N共价三键,则N2更稳定。

