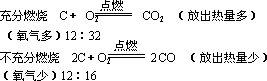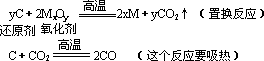|
||||
|
黄冈中学网校提供
碳单质与二氧化碳制取的研究
同步教学
主讲:黄冈中学高级教师 付军
一、一周知识概述
在本周我们一共学习了以下知识:
1、碳元素能组成哪几种单质?
2、坚硬无比、璀璨夺目的金刚石;外表丑陋、不可小视的石墨;一鸣惊人,前途无量的C60;种类繁多的无定形碳。
3、单质碳都具有什么样的化学性质?为什么化学性质相似?
4、二氧化碳制取的原理、思路、方法。
二、重点知识归纳及讲解
1、由同一种元素碳组成的几种性质不同的单质
以单质形式存在的碳有金刚石、石墨和无定形碳等。这些单质的物理性质有较大的差异,其原因是碳原子的空间排列不同;它们的化学性质是相同的,其原因是碳原子的核外电子排布都相同。
2、金刚石和石墨的物理性质与用途的比较
[图表]
3、几种无定形碳的比较
[图表]
4、吸附
木炭和活性炭的吸附是将被吸附物(有色液体、气体、有毒气体等)吸在表面(细管道内),这个变化是物理变化。
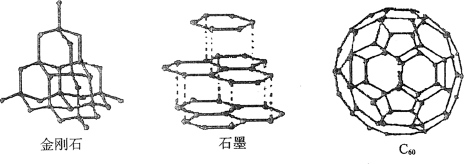
C60分子C60分子是一种由60个碳原子构成的分子,它形似足球,是一种很稳定的分子,主要应用于材料科学,超导体等方面。
金刚石、石墨、C60分子的结构示意图(如上图)
世人瞩目的足球烯-C60.
C60分子是一种由60个碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形,它形似足球,因此又被称为足球烯。
足球烯是美国休斯顿赖斯大学的克罗脱(Kroto, H.W.)和史沫莱(Smalley, R.E.)等人于1985年提出的,他们用大功率激光束轰击石墨使其气化,用1MPa压强的氦气产生超声波,使被激光束气化的碳原子通过一个小喷嘴进入真空膨胀,并迅速冷却形成新的碳原子,从而得到了C60。C60的组成及结构已经被质谱,X射线分析等实验证明。此外,还有C70等许多类似C60分子也已被相继发现。
1991年,科学家们发现,C60中掺以少量某些金属后具有超导性,且这种材料的制作工艺比制作传统的超导材料——陶瓷要简单,质地又十分坚硬,所以人们预言C60在超导材料领域具有广阔的应用前景。
5、碳的化学性质
尽管碳的各种单质的物理性质差异很大,但由于构成它们的碳原子的结构是相同的,因而碳的各种单质具有相同的化学性质。
碳的化学性质有一显著特点:常温下,碳的化学性质很不活泼,但随着温度升高,其化学活动性大大增强。
(1)稳定性:在常温下碳的化学性质不活泼。
(2)可燃性:碳跟氧气的反应有两种情况:
(3)还原性:高温下碳可与氧化物发生反应。
现象:①黑色粉末变红色;②澄清的石灰水变浑浊。
单质碳在高温时具有还原性,它能夺取某些金属氧化物(如ZnO、Fe2O3、Fe3O4、CuO等)中的氧,使金属氧化物还原,故焦炭可用于冶金工业。
某些化学反应在反应过程中能够放出热量或吸收热量,这叫做化学反应中的放热或吸热现象。
6、实验室制取气体的思路和方法
(1)先要了解在实验室的条件下(常温、加热、加催化剂、通电等),可以用什么药品,通过什么化学反应来制取这种气体,也就是我们所说的原料和反应原理。
(2)根据反应物的状态、反应所需要条件和生成气体和性质来设计实验装置。
(3)需要通过实验来验证制得的气体就是所要制取的气体。
7、二氧化碳的实验室制法
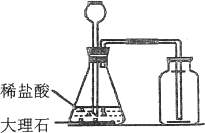
(1)药品:石灰石或大理石(主要成分是CaCO3),稀盐酸。
(2)反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)实验装置:因为上述反应物是固体和液体,反应不必加热,故气体发生装置如右图所示。
(4)收集方法:由于二氧化碳的密度大于空气的密度,且能溶于水,因此只能用向上排空气法收集。
(5)检验。验证:将所得气体通入澄清的石灰水中,若出现白色浑浊,证明收集到的气体是二氧化碳。验满:将燃着的木条放在集气瓶口,若木条熄灭,则证明二氧化碳已收集满。
(6)放置:盛有二氧化碳的集气瓶盖好玻璃片后,要正立放在桌面上。
注意:
(1)实验室制取二氧化碳常用稀盐酸和大理石,不能用稀硫酸代替稀盐酸,原因是稀硫酸与碳酸钙反应后生成的硫酸钙是微溶物,覆盖在大理石的表面上,阻止反应继续进行;也不能用碳酸钠代替大理石,原因是它与稀盐酸反应速度太快,不易控制;不能用浓盐酸与大理石反应制取,原因是浓盐酸有强烈的挥发性,会使制得的二氧化碳中混有HCl气体而使制得的气体不纯。
(2)制取CO2的装置中,长颈漏斗的下端必须插在液面以下,防止生成的气体从长颈漏斗逸出;导气管伸出胶塞的部分不能太长,只露出少许即可,以利于气体的排出;收集气体的导气管必须伸到接近集气瓶的底部,以利于排尽集气瓶内的空气,收集到较纯净的CO2.
8、二氧化碳的工业制法
(1)原理:煅烧石灰 CaCO3
CaO+CO2↑
(2)过程:在工业上,把石灰石放在石灰窑里,经过高温煅烧,就制得生石灰(CaO),同时得到副产品二氧化碳。
三、难点知识剖析
1、证明金刚石和石墨都是由碳元素组成的方法
(1)将两种单质分别与氧气反应均生成CO或CO2.
(2)隔绝空气时相互转化:
2、氧气和二氧化碳的实验室制法的比较
[图表]
- 返回 -