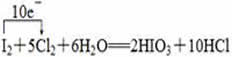字号: 默认 大 中 小
卷分第Ⅰ卷(选择题)、第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 Fe—56 Cu—64
第Ⅰ卷(选择题,共48分)
本卷包括16小题,每小题3分,共48分。每小题均只有一个选项最符合题意。
1、下列试剂中,标签上应标注 和
和 的是( )
的是( )
A.C2H5OH B.HNO3
C.NaOH D.HCl
2、下列叙述正确的是( )
A.碳的摩尔质量为12g
B.22.4L氢气的物质的量是1mol
C.0.1mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
D.1mol NaCl约含6.02×1023个Cl-
3、下列分类不正确的是( )
A.稀豆浆——胶体
B.碳酸钠——正盐
C.铜——非电解质
D.NaH+H2O=NaOH+H2↑——氧化还原反应
4、下列变化需要加入还原剂才能实现的是( )
A.HCO3-→CO2 B.Cl-→Cl2
C.MnO4-→Mn2+ D.NH3→NO
5、下列电离方程式正确的是( )
A.H2SO4=2H++SO42- B.H3PO4
3H++PO43-
C.NaHCO3=Na++H++CO32- D.CaCO3
Ca2++CO32-
6、下列溶液中的c(Cl-)与50mL 1mol·L-1 AlCl3溶液中的c(Cl-)相等的是( )
A.150mL 1mol·L-1氯化钠溶液
B.75mL 1mol·L-1氯化亚铁溶液
C.50mL 3mol·L-1氯酸钾溶液
D.25mL 1.5mol·L-1氯化钙溶液
7、下列各组离子能大量共存的是( )
A.Ba2+、Fe3+、OH-、Cl-
B.Mg2+、Na+、Cl-、SO42-
C.NH4+、Ba2+、NO3-、OH-
D.H+、K+、NO3-、CO32-
8、在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表述正确的是( )
A.体积:④>①>②>③ B.密度:②>③>④>①
C.质量:②>①>③>④ D.氢原子数:①>②>③>④
9、能正确表示下列反应的离子方程式为( )
A.向NaHSO4溶液滴加过量的Ba(OH)2溶液H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.铁钉放入稀硫酸中2Fe+6H+=2Fe3++3H2↑
C.向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液呈红褐色
Fe3++3H2O
Fe(OH)3↓+3H+
D.铜片与硝酸银溶液反应Cu+Ag+=Cu2++Ag
10、按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
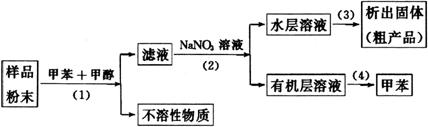
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
11、下列对某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加硝酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液有白色沉淀产生,再加盐酸,沉淀溶解,一定有Ba2+
12、有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀:另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3,据此得知原混合溶液中的c(Na+)为( )(单位mol·L-1)
A.(y-2x)/a B.(y-x)/a
C.(2y-2x)/a D.(2y-4x)/a
13、己知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.H2O2+H2SO4=SO2+O2+2H2O
C.I2+SO2+2H2O=H2SO4+2HI
D.2Fe3++2I-=2Fe2++I2
14、水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列有关说法不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O32-是还原剂
D.每32g O2参加反应,转移电子的物质的量为4mol
15、将100g浓度为18mol/L、密度为ρ g/cm3的浓硫酸加水(密度为1g/cm3)稀释成9mol/L的硫酸,加入的水的体积( )
A.小于100mL B.大于100mL
C.等于100mL D.等于100/ρ mL
16、如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同。打开活塞,使H2与Cl2充分反应(反应为H2+Cl2=2HCl),下列判断正确的是( )
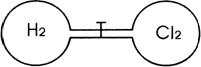
A.开始时左右两室分子数相同
B.反应前后H2室压强相同
C.最终容器内密度与原来相同
D.最终容器内无H2存在
第Ⅱ卷(非选择题,共52分)
二、非选择题(本大题共5小题,共45分。)
17、现有下列十种物质:①O2 ②Fe ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦淀粉溶液 ⑧硫酸钠溶液 ⑨稀硝酸 ⑩Cu2(OH)2CO3
(1)请填写表格的空白处:
分类标准 |
|
氯化物 |
|
|
电解质 |
属于该类的物质 |
② |
|
⑧⑨ |
⑦ |
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学反应方程式为______________________________。
(3)③与⑨发生反应的离子方程式为______________________________。
(4)⑦⑧两种试剂可以采用多种方法鉴别,请写出其中一种方法。
____________________________________________________________。
18、图1、图2为两套实验装置。
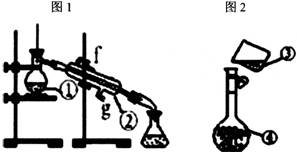
(1)写出下列仪器的名称:①__________;②__________。
(2)仪器①~④中,使用时必须检查是否漏水的有__________。(填序号)
(3)若利用图l装置制取蒸馏水,还缺少的仪器是__________,将仪器补充完整后进行的实验操作的名称为:__________,冷却水从__________口进。
(4)现需配制1.0mol·L-1的NaOH溶液240mL,请完成下列问题:
(i)配制溶液一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为____________________。
(ii)欲完成该实验,应称量__________g NaOH。
(iii)图2装置是某同学配制此溶液时转移操作的示意图,图中的错误是____________________。
(iv)配制过程中下列操作会引起浓度偏低的是__________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥。含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液液面低于刻度线,再补加少量蒸馏水至刻度线.
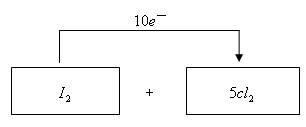
19、向盛有KI溶液的试管中加入少许CCl4后滴加氯水(主要成分为Cl2),CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写)
![]()
(2)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
![]()
(3)把KI换成KBr,则CCl4层变为__________色:继续滴加氯水,CCl4层的颜色没有变化。由此可知,Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________。
显示答案与解析20、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
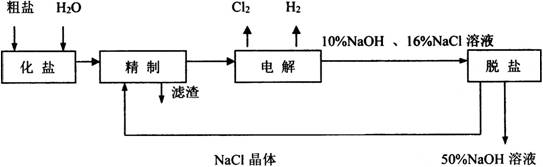
依据上图,完成下列填空:
(1)写出通电条件下电解饱和食盐水的化学方程式______________________________。
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-杂质,精制过程中加入试剂的合理顺序为__________。
A.NaOH溶液、Na2CO3溶液、钡试剂、盐酸
B.NaOH溶液、钡试剂、Na2CO3溶液、盐酸
C.钡试剂、NaOH溶液、Na2CO3溶液、盐酸
(3)钡试剂可以是__________。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为了保证杂质能够完全除去,除杂试剂均稍过量。判断钡试剂已经过量的方法是________________________________________。
(5)请写出精制过程中加入适量盐酸时发生反应的离子方程式____________________。
(6)下表是NaOH、NaCl在不同温度下的溶解度(单位:g/100g水):
温度(℃) |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
70℃ |
80℃ |
90℃ |
100℃ |
NaOH |
42 |
51 |
109 |
119 |
129 |
145 |
174 |
299 |
314 |
329 |
347 |
NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
由此可知:
脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、__________(填写操作名称)除去NaCl;该工业流程中可循环利用的物质是__________。
显示答案与解析21、有一固体由Na2CO3、NaCl、CaCl2、CuSO4中的一种或几种物质组成,为检验此混合物的组成,进行如下实验:
①将少量固体混合物溶于水搅拌后,得无色透明溶液;
②在上述溶液中滴加硝酸钡溶液,有白色沉淀生成;
⑨过滤,在白色沉淀中加入过量稀硝酸,沉淀全部溶解。由此判断:
(1)该混合物中一定有__________,一定没有__________,可能有__________。
(2)如果要确定可能有的物质是否存在,请设计一个实验方案,简要说明操作步骤、现象和结论。
___________________________________________________________________________
___________________________________________________________________________
显示答案与解析三、计算题(本题包括l小题,共7分)
22、(1)将50g CuSO4·5H2O溶于水配成100mL溶液
①该溶液中CuSO4的物质的量浓度为__________。
②将该溶液和1mol·L-1 H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和),混合液中SO42-浓度为__________。
③向溶液中加入足量铁粉,充分反应后铁粉有剩余。此时溶液中Fe2+的物质的量浓度为__________。
(2)有如下氧化还原反应(未配平,已知BrF3中F为-1价):
BrF3+H2O——HBrO3+Br2+HF+O2↑
①若上述反应每生成2mol Br2,就会生成a mol HBrO3和b mol O2,则a、b之间的关系为____________________;
②上述反应中若有0.3mol H2O被氧化,则被水还原的BrF3的物质的量为__________mol。