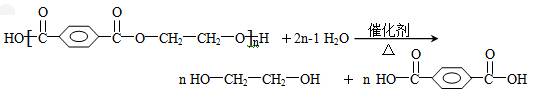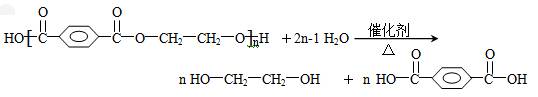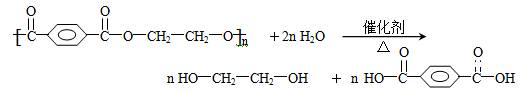字号: 默认 大 中 小
试卷满分100分 考试用时90分钟
可能用到的相对原子质量:H―1 C―12 N―14 O―16 Na―23 Si―28 S―32 Fe―56 Ga―70
第Ⅰ卷
一、选择题:本题共14小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1、化学与材料、生活和环境密切相关。下列有关说法中正确的是( )
A.侯氏制碱法是先将CO2通入饱和NaCl溶液后,再通入NH3
B.新型材料聚酯纤维、光导纤维都属于有机高分子材料
C.PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物
D.“神十”航天服是由碳化硅陶瓷和碳纤维复合而制成的,它是一种新型无机非金属材料
2、设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.18gD2O含电子数目为10NA
B.标准状况下,NA个HF分子所占的何种约为22.4L
C.4.5g SiO2晶体中含有的硅氧键的数目为0.3NA
D.常温下将0.1mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA
3、已知X、Y、Z中含同种元素,其中X、W是单质且有如图所示的转化关系,则X、W依次为( )
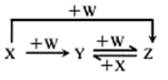
A.Fe,Cl2 B.S,O2
C.N2,O2 D.C,O2
4、用下列实验装置进行相应实验,装置正确且能达到实验目的的是( )
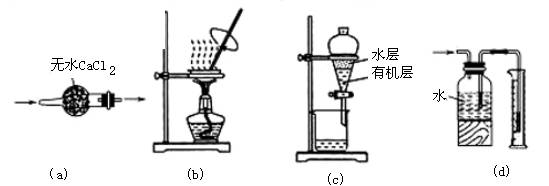
A.用图a所示装置干燥NH3气体
B.用图b所示装置蒸发NaCl溶液得NaCl晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氯气的体积
5、短周期元素A、B、C、D、E原子序数依次增大,其中A、C同主族,B、E同主族,A的最外层电子数与次外层电子数相等,E是太阳能转化为电能的常用材料,则下列说法正确的是( )
A.工业上用电解熔融氧化物的方法制备C单质
B.离子半径:C>D
C.熔融它们的单质,所克服的微粒间作用力都相同
D.含D的盐溶液都显酸性
6、若苯的环上三个氢原子分别被-Cl、-Br、-I取代,能生成的同分异构体数目是( )
A.8种 B.9种
C.10种 D.11种
7、下列表示对应化学反应的离子方程式正确的是( )
A.Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑
B.用惰性电极电解CuCl2溶液:2Cu2++2H2O
4H++O2↑+2Cu
C.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液体积混合
D.在酸性重铬酸钾溶液中加入少量乙醇
3CH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O
8、向含![]() 、Fe2+、Br-、I-各0.1mol的混合溶液中通入Cl2,Cl2与它们可能发生如下四个反应:①
、Fe2+、Br-、I-各0.1mol的混合溶液中通入Cl2,Cl2与它们可能发生如下四个反应:①![]() +Cl2+H2=SO42-+2Cl-+2H+,②2Fe2++Cl2=2Fe3++2Cl-,③2Br-+Cl2=Br2+2Cl-,④2I-+Cl2=I2+2Cl-。当通入0.2molCl2时,发生的反应是( )
+Cl2+H2=SO42-+2Cl-+2H+,②2Fe2++Cl2=2Fe3++2Cl-,③2Br-+Cl2=Br2+2Cl-,④2I-+Cl2=I2+2Cl-。当通入0.2molCl2时,发生的反应是( )
A.①②④ B.①③④
C.②③④ D.①②③
9、已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1)△H1,
2CO(g)+O2(g)=2CO2(g)△H2 2H2(g)+O2(g)=2H2O(1)△H3;
2H2(g)+O2(g)=2H2O(g)△H4 CO(g)+2H2(g)=CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
A.△H1<0,△H2>0 B.0>△H3>△H4
C.2△H5+△H1>0 D.△H1=△H2+△H3-2△H5
10、某实验小组依据反应AsO43-+2H++2I-![]() AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是( )
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是( )

A.pH>0.68时,甲烧杯中石墨为负极
B.pH=0.68时,反应处于平衡状态
C.pH<0.68时,氧化性I2< AsO43-
D.pH=5时,负极电极反应式为2I――2e-=I2
11、有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3分别为1mol/L和0.5mol/L,取10ml此混合酸,向其中加入过量的铁粉,反应结束后产生的气体在标准状况下的体积是(HNO3被还原成NO)( )
A.0.168L B.0.112L
C.0.672L D.0.224L
12、下列有关实验操作、现象和解释或结论都正确的是( )
选项 |
实验操作 |
现象 |
解释或结论 |
A. |
向某溶液中加入足量稀盐酸无现象,再滴加BaCl2溶液 |
有白色沉淀生成 |
原溶液中有SO42- |
B. |
Agl沉淀中滴入稀KCl溶液 |
有白色沉淀生成 |
AgCl比AgI更难溶 |
C. |
向CH3CH2X中加入少量AgNO3溶液,加热 |
有浅黄色沉淀生成 |
CH3CH2X中含有Br- |
D. |
C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
KMnO4溶液褪色 |
使KMnO4溶液褪色的是乙烯 |
13、如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
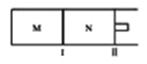
A.若x=3,达到平衡后A的体积分数关系为:
B.若x<3,C的平衡浓度关系为:c(M)<c(N)
C.若x>3,达到平衡后B的转化率关系为:
D.x不论为何值,平衡时M、N中的平均相对分子质量都相等
14、在1L密闭容器发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-Q kJ·mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g)△H=-Q kJ·mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
时间/浓度 |
c(NH3)(mol·L-1) |
c(O2)(mol·L-1) |
c(NO)(mol·L-1) |
起始 |
0.8 |
1.6 |
0 |
第2min |
0.6 |
a |
0.2 |
第4min |
0.3 |
0.975 |
0.5 |
第6min |
0.3 |
0.975 |
0.5 |
第8min |
0.7 |
1.475 |
0.1 |
第10min |
0.7 |
1.475 |
0.1 |
下列说法正确的是( )
A.第4min、第8min时分别达到化学平衡,且平衡常数相同
B.反应在第2min时改变了某一条件,该条件一定是升高温度
C.反应在第2min到第4min时,O2的平均速率为0.1875mol·min-1
D.在开始反应的前2min内,该反应放出0.2QKJ的热量
第Ⅱ卷
二、非选择题(共58分)
15、(7分)某研究小组为了制备Na2S2O3,做了如下实验:已知Na2S2O3易溶于水,遇酸易分解。
I.实验原理:Na3SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
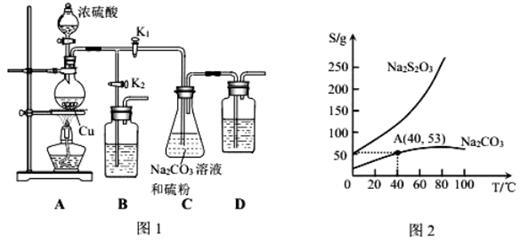
Ⅱ.实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
Ⅲ.实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置D的作用是_____。写出C装置中发生的化学方程式:_________________________。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。
(4)将C中为40℃含50g水的饱和Na2S2O3·5H2O,可得Na2S2O3·5H2O_____g.
16.(9分)目前市售氧化剂有很多种,高铁酸钾(Na2FeO4)是一种绿色氧化剂。
(1)制备高铁酸钾(Na2FeO4)的方法有很多种,可以用次氯酸钠在强碱性的NaOH溶液中氧化Fe(NO3)3制备。请写出该反应的化学方程式:_____________。
(2)测定Na2FeO4样品纯度:
①取样品2.00g,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;
②将所得NaCrO4酸化;
③在所得NaCr2O7溶液中加入指示剂,用1.00mol·L-1的(NH4)2Fe(SO4)2滴定至终点,消耗溶液体积为28.00 mol。已知整个过程中发生的反应为下:
ⅰ.□Cr(OH)4-+□FeO42-+□___=□Fe(OH)3(H2O)3↓+□CrO42-+□___;
ⅱ.2CrO42-+2H+=Cr2O72-+H2O;
ⅲ.Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①滴定过程中,能否选用KSCN溶液作为指示剂______填(“能”或“否”);理由是:____________。
②配平反应式ⅰ:
□Cr(OH)4-+□FeO42-+□___=□Fe(OH)3(H2O)3↓+□CrO42-+□_____
③NaFeO4样品的纯度是________。(保留三位有效数字)
17.(11分)工业上以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备Li2CO3的工艺流程如下:
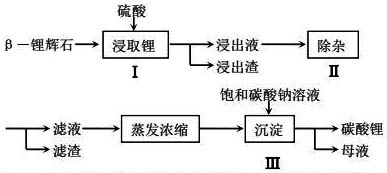
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+等杂质,需在搅拌下加入石灰石以调节溶液的PH到6.0~6.5,过滤,能除去的部分杂质离子是_____,然后分离得到浸出液。
(2)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去Fe2+等杂质金属离子,用H2O2将Fe2+除去的离子反应方程式_____________;步骤Ⅱ所得滤渣主要成分的化学式是_____________.
(3)Na2SO4·10H2O是工业生产的一种重要化工原料.步骤Ⅲ所得母液溶质主要是Na2SO4和少量NaOH.可以向母液中加入适量的_______,再通过_____、_______、过滤、洗涤,得到Na2SO4·10H2O晶体。
显示答案与解析18.(7分)
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是______________。
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<0
B.C(s)+H2O(g)=CO(g)+H2(g) △H>0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其负极电池反应式为:_____________;
(3)燃料电池是一种高效、环境友好的发电装置.燃料电池的能量转化率理论上可高达85%~90%(现在实际已达到40%~60%).CO、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、890.3kJ、1366.8kJ.相同质量的这3种燃料,完全燃烧时放出热量最多的是_______(填写物质的化学式).
显示答案与解析19.(9分)
某化学兴趣小组自行设计实验对废PET(聚对苯二甲酸乙二醇酯)进行化学解聚制备PET的初始原料对苯二甲酸(TPA)及乙二醇(EG),以实现治理污染、资源的循环利用。
查阅相关资料,得到主要试剂及产物的性质:
物质 |
相对分子质量 |
性质 |
废饮料瓶碎片 |
|
聚对苯二甲酸乙二醇酯:乳白色或浅黄色的聚合物。 |
乙二醇(EG) |
62 |
无色无臭液体,对动物有毒性。沸点:196~198℃,与水混溶。 |
对苯二甲酸(TPA) |
166 |
白色晶体或粉末,低毒。弱酸。300℃以上升华。不溶于水、乙醚、氯仿等大多数有机溶剂,可溶于DMF等强极性有机溶剂。 |
实验过程如下:
(一)解聚
实验装置如图所示,A为三颈烧瓶,B为直形冷凝管,C为吸滤芯瓶,各接口均为玻璃接口。向装置中加入一定量废饮料瓶碎片及辅助试剂(催化剂、水等)。缓慢搅拌,加热。待温度计上的温度显示高出200℃时,停止加热。则:
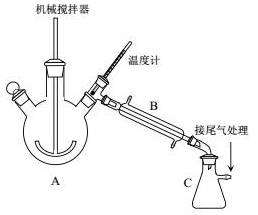
(1)写出聚对苯二甲酸乙二醇酯解聚的化学反应方程式:____________________。
(2)C中收集到的是____________________;C装置吸滤瓶__________(填“能”或“不能”)换页成敞口锥形瓶,原因:______________________________。
(3)成品聚对苯二甲酸乙二酯是一种结晶性好,无色透明,极为坚韧的材料。有玻璃的外观,无臭、无味、无毒,易燃,燃烧时,产生蓝色边缘的黄色火焰。其燃烧反应属于__________。
A.聚合反应 B.加成聚合反应
C.综合聚合反应 D.高分子化学反应
(4)工业上生产“PET”的反应式为:
nHOCH2CH2OH+nHOOC—![]() —COOH→
—COOH→
![]() ,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为__________。
,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为__________。
20.(15分)研究CO、NO2、SO2等大气污染气体的处理具有重要意义。
(1)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:__________________________.
(2)已知反应:![]() 的△H=-41.8kJ·mol-1
的△H=-41.8kJ·mol-1
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________.
(3)CO可用于合成甲醇,反应方程式为![]() .
.
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为_____反应.(填“放热”或“吸热”)
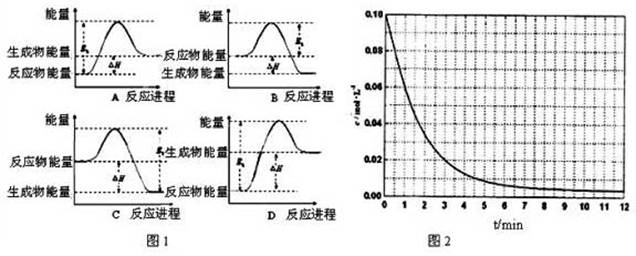
②该反应的焓变为△H,活化能为E0,下列能量关系图(图1)合理的是______.
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH3OH浓度随时间的变化曲线.